微生物臨床數據判讀
出自KMU Wiki
目錄 |
一、 作者簡介
吳俊忠
現職:
陽明大學生物醫學暨工程學院院長
成功大學醫學院醫學檢驗生物技術學系教授
學歷:
美國賓州費城天普大學微生物暨免疫研究所博士
二、 本書摘要
本書為淺顯易懂的中文臨床微生物學入門必備書。除以淺顯易懂的文字表達外,所採用臨床微生物的圖片均自行拍攝或由國內專家提供,彌足珍貴。書內相關章節的病例討論及參考文獻也大多引用國內學者的學術論文期刊,以期讓讀者能明瞭台灣現狀。本書除適合醫技系初學者外,也適合醫學系學生、醫院醫檢師、感染科醫師,感控人員及相關醫護人員學習使用,相信在閱讀本書後,將能對臨床微生物學有概括的了解。
三、 佳句摘錄
胃部只有一種細菌能感染,主因是胃酸的PH值很低,99%細菌通過胃時會被胃酸殺死,幽門桿菌具有很強的尿素脢,釋放氯離子,使菌體外具鹼性,使其有機會感染胃內的黏膜細胞。
四、 讀書會討論內容
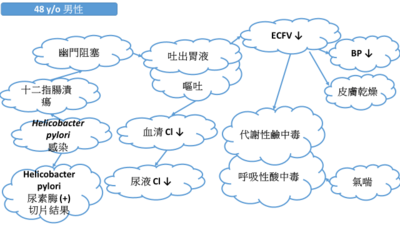
緣起於此「學士後醫學檢驗數據整合判讀學士學位學程」黃莉文老師以「吐出大量胃液」的案例探討如圖所示
從此雲朵關係圖看到胃幽門螺旋桿菌對病人這麼有影響力,進而想知道這株細菌的一切! 進而閱讀了《臨床微生物學:細菌與黴菌學》這本書
胃幽門螺旋桿菌是什麼呢?
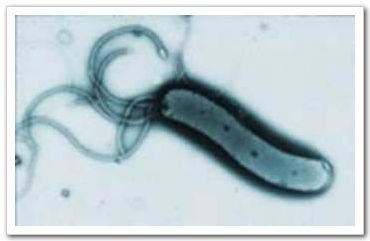
圖一:胃幽門螺旋桿菌(Helicobacter pylori)電子顯微鏡圖片 幽門螺旋桿菌是在1983年由澳洲病理科醫師 Warren及博士Marshall 首次由人類胃黏膜分離出來的一種革蘭氏陰性、呈螺旋狀、微嗜氧的細菌, 而人類是其唯一的宿主,主要發生在人類胃黏膜上。博士Marshall為了求證他們的發現,就用自己身體做了實驗,他吞下一匙培養出來的胃幽門螺旋桿菌,果不其然很快的他就得到了胃炎,最後用大量的抗生素才痊癒。他們秉科學家實驗的精神,為人類找到好幾十年來困擾著病患胃病的原因,後來在2005年獲頒諾貝爾獎的殊榮。
圖二:Professor Barry Marshall and Dr Robin Warren合照
1991年,加拿大多倫多大學報導一項調查, 27名患有胃炎的小孩有23人帶有幽門螺旋桿菌,同時發現他們中間有18人的兄弟在10年內也感染了幽門螺旋桿菌,而其中一半以上的父母也帶有病菌,這個統計證實胃炎、胃潰瘍是會傳染的。那究竟傳染途徑為何呢?幽門螺旋桿菌病菌是從口腔進入胃腸,可能是因為親吻、上廁所後沒有洗手,或和人接觸後不洗手而用手拿食物吃,因而感染到病菌。這細菌會緊附在胃部的黏液內層膜,因此不會受到胃酸的影響。當細菌在內層膜繁殖,穿開了小孔洞,胃酸也就會四處流竄侵蝕別的細胞、器官,就變成了內白外紅的瘡口,帶來胃痛、胃灼熱、胃潰瘍、十二指腸潰瘍等病症。
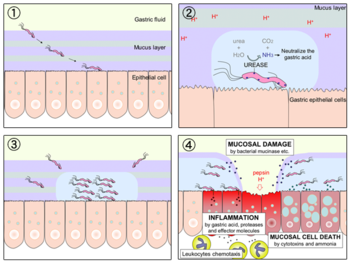
圖三:胃幽門螺旋桿菌感染示意圖
人們一旦在感染幽門螺旋桿菌後,在臨床上八成的感染者是不具有任何臨床症狀,但有近10%的罹患者會衍生胃炎、胃十二指腸潰瘍,若不接受特定抗生素治療,其在持續感染數十年後,或許亦會使其繼續感染 個體進一步衍生黏膜相關淋巴組織淋巴瘤(mucosaassociated lymphoid tissue lymphoma,MALToma). 甚至胃賁門區腺癌。因此,在1994年幽門螺旋桿菌即被世界衛生組織確定為I類致癌因子。
一、 胃幽門螺旋桿菌在台灣的盛行率 對於胃幽門螺旋桿菌在全球的盛行率已經高達50%,甚至在已開發國家更高達90%,而在臺灣地區也不例外,其感染率亦達54%左右。 很多研究也指出幽門螺旋桿菌與胃、十二指腸方面的疾病有關,胃潰瘍患者幽門螺旋桿菌之流行率約為83.8%。彭道雄醫生關於北高雄胃幽門螺旋桿菌的研究上指出,示胃潰瘍、十二指腸潰瘍、以及胃潰瘍合併十二指腸潰瘍之幽門螺旋桿菌感染率分別為 43.69%、53.19%、以及63.64%(p < 0.05)。另外感染幽門螺旋桿菌之胃潰瘍患者中以O型血者較多(p < 0.05)﹔感染幽門螺旋桿菌之十二指潰瘍患者中以B型血者較多(p < 0.05),不過以上這些資料是由於有特殊的人文與地理環境限制,不能視為整個台灣的概況,但多了解臺灣各地區消化潰瘍之狀况對預防醫學會有所助益。 二、 胃幽門螺旋致病因子
造成胃黏膜屏障損傷的機制主要取決於幽門螺旋桿菌鞭毛本身動力活躍性、黏附特性、胃黏膜的定殖以及病人個體本身胃黏膜的防禦力,再加上各種相關毒力因子(virulence factor)及酵素所促發感染個體的一系列免疫反應,進而導致胃黏膜漸進性的傷害。 。幽門螺旋桿菌本身菌體兩端呈圓鈍狀,其中的一端具有4~6根帶鞘的鞭毛。每根鞭毛長約2.5μm,直徑約為30nm,是幽門螺旋桿菌特殊運動的工具,對該菌是否能夠去感染個體是一個重要的結構,它能使細菌自由遊走並穿透胃黏膜層,並在黏膜下層形成微鹼性環境而避免生存於胃酸低PH值環境下;菌體一旦定殖於黏膜下層,就會牢固黏附到胃或十二指腸上皮細胞層中。 胃因為胃酸的存在且避免外來細菌病從口入,所以始終長期保持PH1~2的環境。一開始病理科醫師Warre及博士Marshall也很難相信會有細菌能夠存活在其中。後來發現「黏附素脂蛋白」及「尿素脢」都是將胃酸環境中和的一個重要因子,前者是去分泌的特殊胃酸抑制蛋白(acid
inhibitory protein)且能使胃黏膜質子泵(proton pump) 失去活化;後者則是可在酸性環境中水解尿素,而釋放出「氨氣」及「二氧化碳」,而「氨氣」能使其所生存周邊的環境變成弱鹼性,兩者皆是在為胃幽門螺旋桿菌創造一個中性的環境。
另外,胃幽門螺旋桿菌還具有許多相關毒力因子,像是一種分子量為87kD的細胞毒素,它能使動物細胞造成不等程度的「空泡變性」的病變,而這種毒素稱之為空泡毒素(VacA),VacA本身是一種分泌型蛋白毒素,在感染宿主中的細胞內阻礙細胞內膜融合作用,藉此可以導致胃上皮細胞的損害,並衍生空泡樣變性進而使細胞凋亡、細胞架構重組,最終致使細胞死亡。另一種分子量為128kD的蛋白質,稱之為細胞毒素相關蛋白(CagA),是第一個被科學家用來檢視身體內是否感染幽門螺旋桿菌的特異性抗原。由研究證實CagA基因的存在是產生空泡毒素(VacA)所必須的,並能促進細胞激素IL-8釋放,由此來加重胃黏膜組織的傷害,故目前認為CagA+的幽門螺旋桿菌菌株是較具有高度毒性的致病率。 目前統計指出胃炎罹患者中的抗CagA陽性率(以ELISA方法測定)約為70~75%,而十二指腸潰瘍罹患者中幾乎達百分之百。由基因分析更指出CagA只存在I型菌株中,而VacA則存在I和II兩個型中。 這些細胞毒素接下來會引發胃上皮細胞就會發生一系列所謂的細胞骨架重組以及酪氨酸